低温冻存技术已在很多领域发挥重要作用。上海交通大学黄永华教授团队阐述了细胞冻存典型方式及损伤机理,对细胞冷冻策略优化及设备研究进展进行了分类总结。相关论文以“细胞冻融策略优化及设备研究进展”为题发表在《制冷学报》上。
总体而言,目前主要有程序化慢速冷冻和玻璃化快速冷冻这两种冻存方式,其中慢速冷冻不仅更容易使细胞脱水,而且易导致胞内冰晶损伤和溶质损伤(图1)。
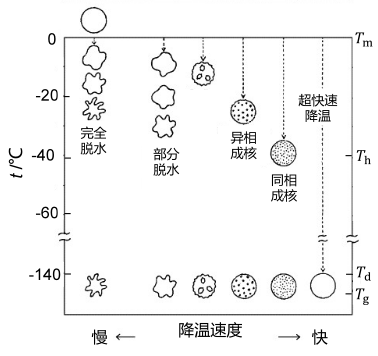
图 1 不同降温速度时细胞冻存状态
相比之下,玻璃化冷冻则无冰晶产生,且时间极短,细胞内浓度来不及变化,可避免低温损伤。但所需要的降温速率(即临界降温速率)极高,如对水需要107~8℃/min级别,几乎无法实现。通常通过增加溶液浓度尽量减小危险区温跨范围并快速经过(图2)。

图 2 某典型低温保护剂溶液相图
为了提高冻存成功率,样本载体、冷冻设备以及降温策略方面获得了以下成功经验和注意事项:
首先,玻璃化冻存要求有合适的冻存载体,大致可分为细管形和环网形两种(图3)。
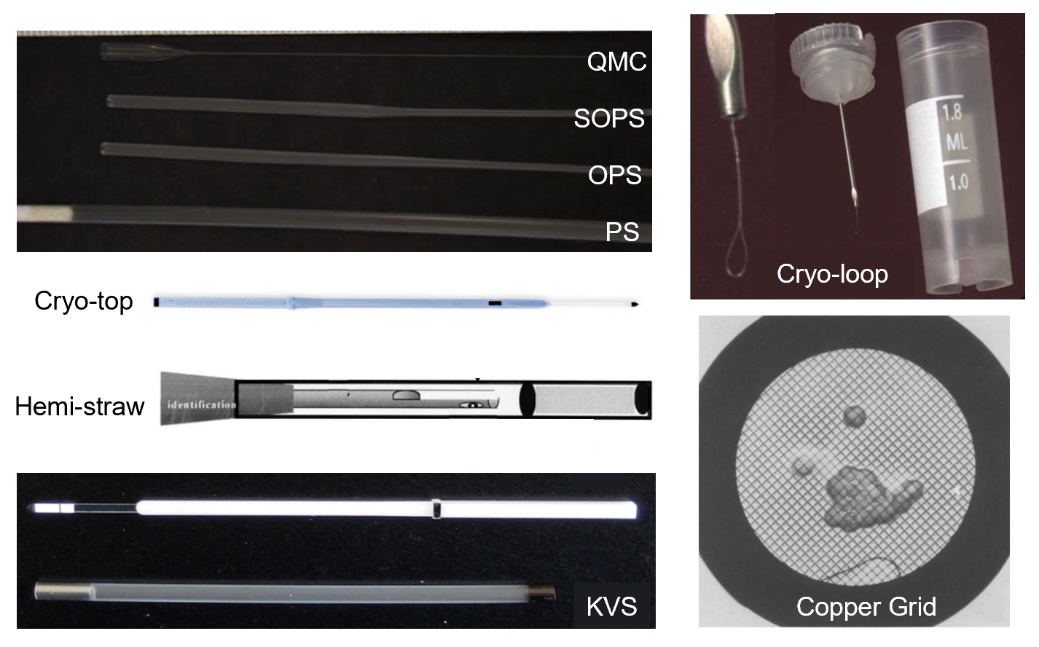
图 3 典型玻璃化快速冷冻载体
其次,除了细管状和环网状玻璃化冷冻载体,还发展出一种以液滴形式进行玻璃化快速冷冻的方法,包括液滴直接接触液氮冷却法和液滴接触预冷固体表面冷却法(图4)。前者会在样本周围形成一层蒸汽,影响观测细胞内外冰晶形成情况。后者在一定程度上可以避免这一现象,有利于显微成像。
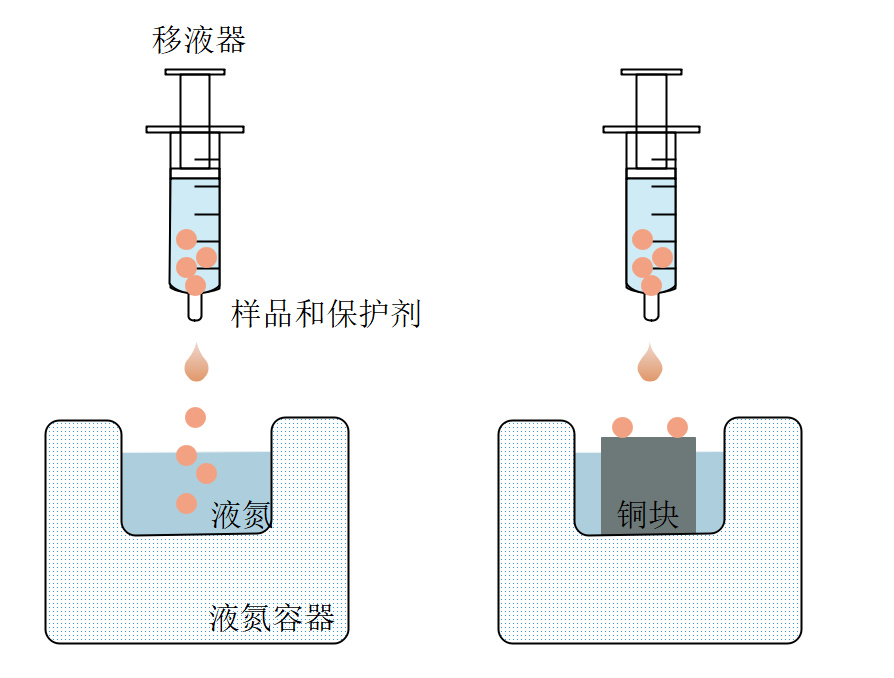
图 4 液滴形式玻璃化冷冻示意图
此外,喷射、微流控、细胞打印等创新技术也逐渐应用于生物细胞的冷冻保存,取得了良好进展(图5)。
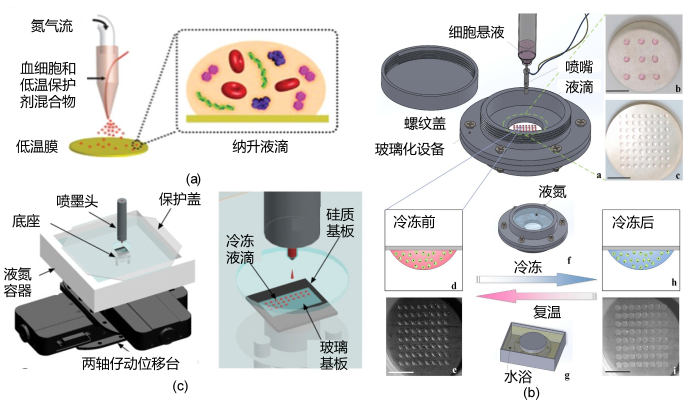
图 5 三种液滴玻璃化冷冻装置
(a)基于移液器和低温聚乙烯膜的血红细胞液滴玻璃化冷冻;(b)基于超薄银膜和细胞打印机的两舱室非接触液滴玻璃化冷冻;(c)基于细胞打印机和规制基底的无低温保护剂液滴玻璃化冷冻。
其中,微流体技术为细胞外环境中低温保护剂浓度连续变化提供可能,从而减小低温保护剂带来的渗透性损伤(图6)。而传统操作中细胞内外渗透压会发生突变,可能对细胞造成渗透性损伤。
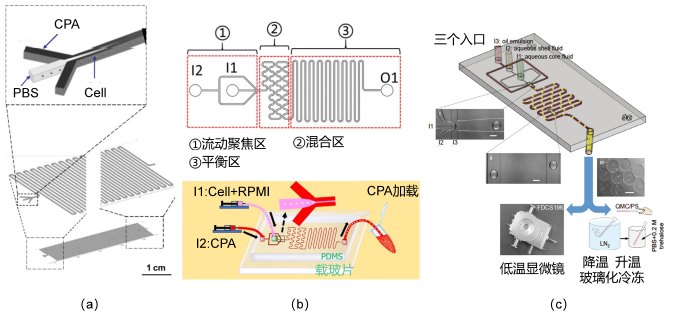
图 6 微流体技术在细胞冻存中的部分应用
(a)Song等三入口式低温保护剂添加去除装置;(b)Zheng等二入口式低温保护剂添加去除装置示意;(c)Huang 等含细胞的藻酸盐水凝胶微胶囊制取及玻璃化冷冻装置示意。
为了提高冻存细胞的存活率,复温过程同样需要避免重结晶对细胞造成的损伤。物理场的引入,主要通过提高升温速率或影响水分子的运动状态来抑制重结晶现象(图7)。
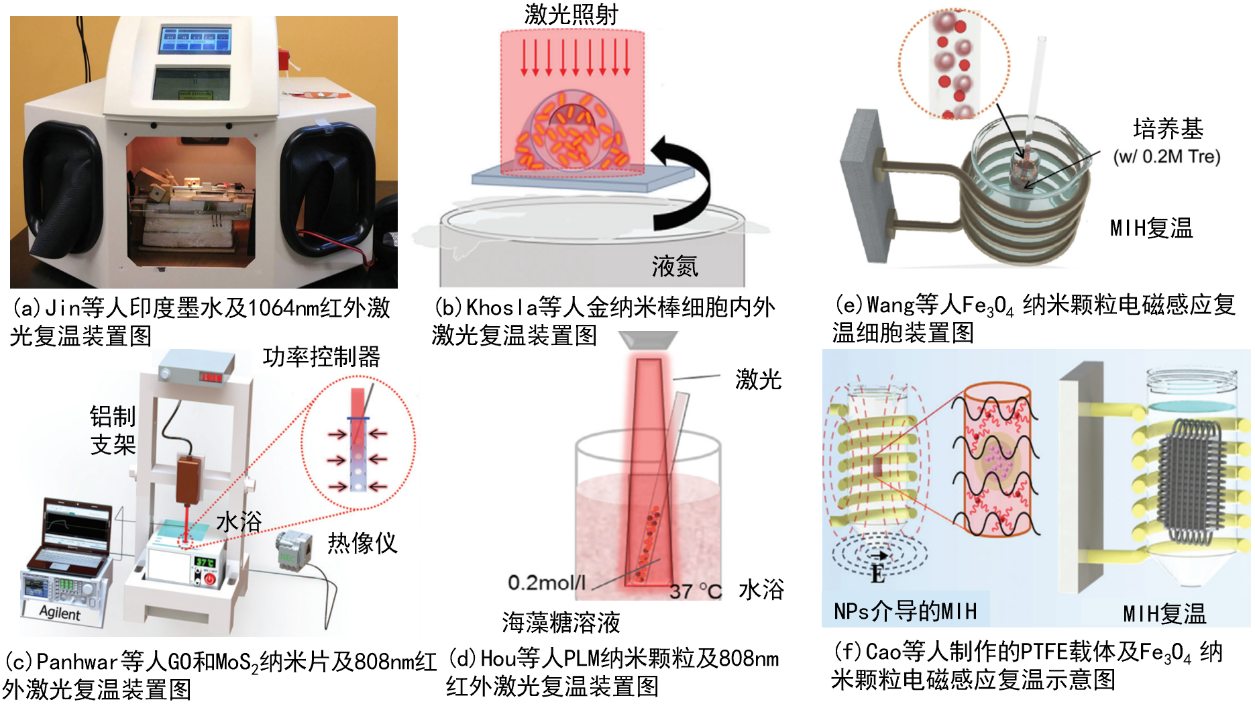
图 7 物理场在冻存细胞中的应用
(a)Jin等印度墨水及1064nm红外激光复温装置;(b)Khosla等金纳米棒细胞内外激光复温示意;(c) Panhwar等GO和MoS2纳米片及808nm红外激光复温示意;(d)Hou等PLM纳米颗粒及808nm红外激光复温示意;(e)Wang等Fe3O4纳米颗粒电磁感应复温细胞示意;(f)Cao等制作的PTEE载体及Fe3O4纳米颗粒电磁感应复温示意。
总结
研究者认为完全玻璃化快速冷冻具有可以避免低温冻存损伤的机理优势,但受限于升降温速度和低温保护剂毒性,现有的玻璃化冷冻方法仍不具有普适性,特别是在低浓度的情况下。
升降温策略及载体设备层面的优化,以减小体量、强化传热为宗旨。此外,随着高速高清成像技术和显微技术的发展,低温显微成像系统可为细胞内外冰晶生长的可视化研究提供支撑。
文章来源:http://qikan.cqvip.com/Qikan/Article/Detail?id=7106888370

