哺乳动物的生物样本--细胞、组织和器官--被广泛用于科学研究和临床应用中。生物保存使它们能够广泛地分布、运输和应用(图1)。生物保存还有助于提供可靠的哺乳动物细胞来源,特别是干细胞、血细胞和基因工程细胞,这些都是基于细胞的医学不可缺少的。

图1. 哺乳动物生物标本的保存。

图1. 哺乳动物生物标本的保存。
有两种常见的低温保存方法:慢速冷冻和玻璃化冷冻。慢速冷冻通常用于保存哺乳动物细胞和微组织,冷却速度约为1℃/min。玻璃化冷冻直接将生物样本从液态转变为玻璃态,以尽量减少或消除冰的形成。
西安交通大学生命科学与技术学院的黄海水博士团队研究了这些经典的生物保存方法的过程,相关的低温损伤机制,以及这些方法的适用性的限制,并强调了克服这些限制的最新进展。相关研究以“Advanced technologies for the preservation of mammalian biospecimens”为题发表在《Nature Biomedical Engineering》上。
保存过程
根据温度和溶质的浓度,生物样本可以是液态或玻璃化,这是稳定的状态,或过冷或过饱和,这是热力学上不稳定的阶段(图2a)。生物样本通常被保存在其中一个稳定的区域:要么是长期低温保存的玻璃化状态,要么是短期低温保存的液体状态。图2b,c描述了生物保存过程的热力学路径。
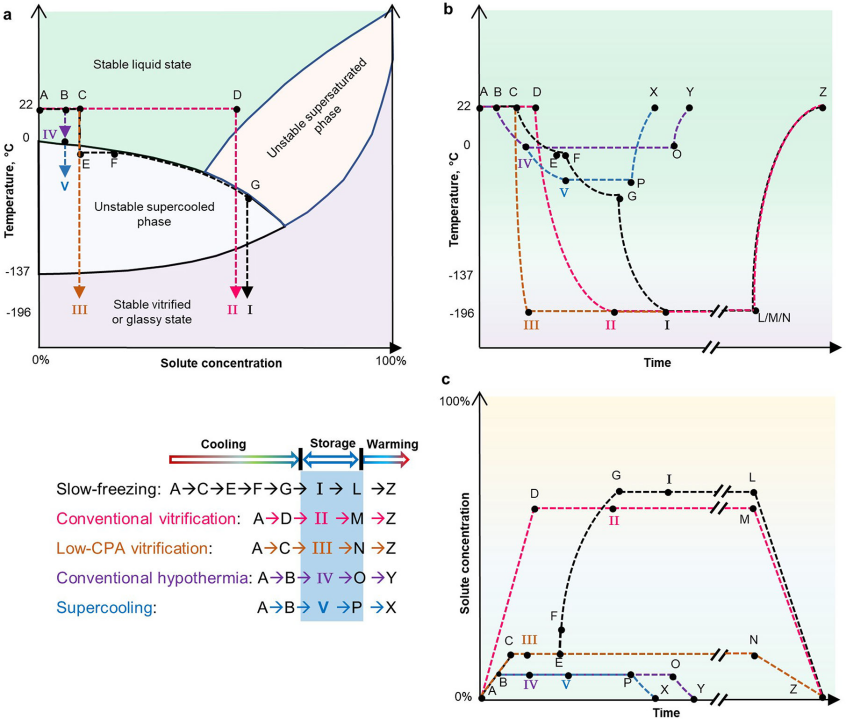
图2. 五种主要生物样本保存方法的相图以及热和渗透时间过程。

图2. 五种主要生物样本保存方法的相图以及热和渗透时间过程。
所有经典的保存方法都有内在的限制。在慢速冷冻过程中,生物样本会形成冰块、冷冻浓缩和形态变形。细胞外的冰晶会因“挤压”而损坏质膜,任何明显的细胞内冰的形成对细胞几乎都是致命的。冻结浓度会引起明显的渗透压,导致细胞脱水和高浓度溶质下的变形。
传统的玻璃化冷冻使用高浓度的CPA(冷冻保护剂),以提高生物样本的玻璃转化温度,降低其水分子的扩散系数。然而,由于高温下的高浓度CPA可能对哺乳动物细胞有很强的毒性,所以通常要尽量缩短暴露时间,降低温度。
慢速冷冻的进展
慢速冷冻涉及到细胞特定的冷却速率,以避免过度的溶质效应和细胞内冰的形成(图3a)。
1. 膜运输的动态测量
了解细胞的渗透行为和量化水和CPA在细胞膜上的运输特性是制定最佳慢冻程序的先决条件。但主流方法不能用来研究特定细胞的渗透反应。然而,带有微通道和用于捕获细胞的灌注室的聚二甲基硅氧烷或玻璃微流控设备(图3b)可以以单细胞分辨率测量这些特性。
2. 低温保存芯片
微流控芯片也可用于提高低温保存的效率、准确性和安全性。例如,微流体通道已被用来以精简的方式冷冻、解冻、培养和分析细胞悬浮液,以节省时间、劳动力和成本(图3c)。微流控设备可以为样品制备和分析提供更高水平的可操作性,为冷却和升温程序提供可控性,并优化冷冻保存条件。
3. 磁性冷冻保存
细胞内冰的形成,特别是细胞内大晶体的形成,对哺乳动物细胞几乎总是致命的。对生物样本施加磁场可以改变冰的成核和传播的动力学,以改善慢速冷冻。例如,通过施加外部磁场,人类牙周韧带细胞和牙髓组织通过慢速冷冻被保存下来,CPA浓度明显降低,然后移植到病人身上,使正常的牙周韧带愈合(图3d)。
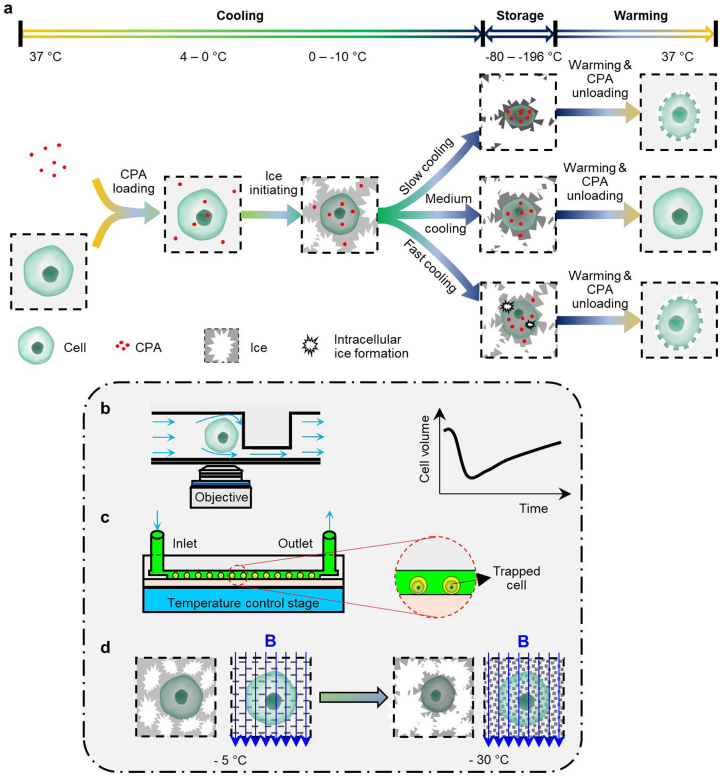
图3. 慢速冷冻。a, 慢速冷冻的步骤。b,微流控灌注。c,低温保存芯片。d,磁性冷冻保存。
为了有效抑制脱硝和冰的再结晶,临界升温速率必须超过临界冷却速率至少一个数量级。然而,在37℃水浴中通过对流加热可达到的升温速率只有10-100℃/min。通过微注射涂有炭黑的金纳米棒,用脉冲激光束刺激斑马鱼胚胎,在低浓度的CPA中实现了1.4×107℃/min的升温速率(图4e)。
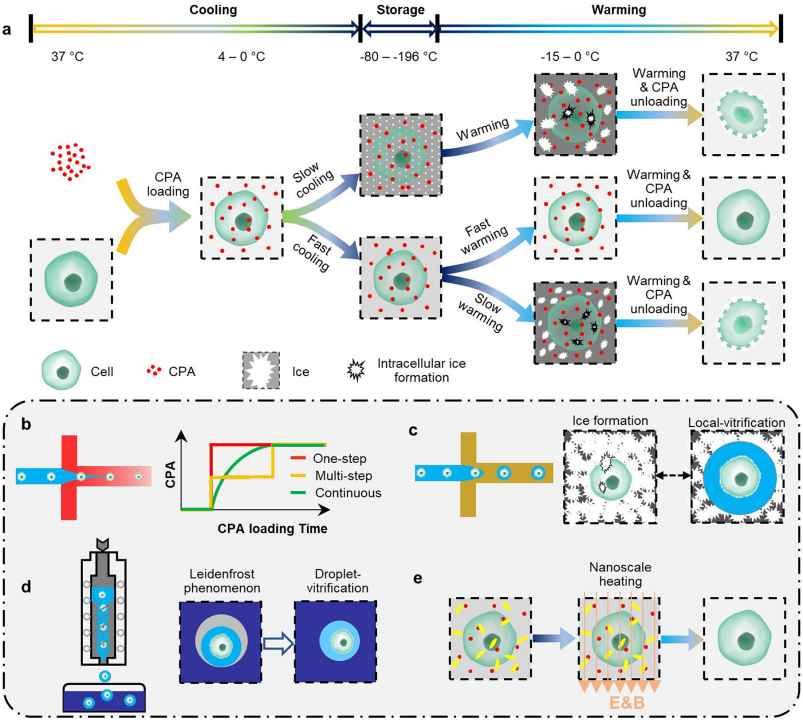
图4. 玻璃化冷冻。a,玻璃化的步骤。b,自动装载CPA。c,水凝胶微囊化。d,液滴玻璃化。e,纳米级加热。

图3. 慢速冷冻。a, 慢速冷冻的步骤。b,微流控灌注。c,低温保存芯片。d,磁性冷冻保存。
玻璃化冷冻的进展
玻璃化需要高浓度的细胞毒性CPA来防止冰的形成。传统上,CPA的装载和卸载是通过繁琐和耗时的多步骤程序进行的。此外,CPA的使用限制了样品的大小为100微升,以获得足够高的冷却和升温速率(图4a)。
1. 自动CPA装载和卸载
各种类型的微流控装置已经被开发出来,以促进和改善玻璃化过程中多步骤CPA加载和卸载过程。这些设备可以自动添加和移除CPA,其渗透变化曲线比传统的分步法更平滑(图4b)。
2. 水凝胶微囊化
以通过改变要保存的生物样本的生物物理和生物化学特性可以进行玻璃化冷冻。例如,限制在海藻酸钙水凝胶基质中的水比自由散装水更容易玻璃化。海藻酸钙水凝胶具有抑制脱化和再结晶的显著能力,因此可用于创造局部纳升体积的无冰微环境(图4c)。
3. 液滴玻璃化
对于低CPA浓度,通过液滴发生器将充满细胞的微液滴直接 “射入”液氮,可以实现高冷却率和高产量的玻璃化(图4d)。
4. 纳米级的升温
为了有效抑制脱硝和冰的再结晶,临界升温速率必须超过临界冷却速率至少一个数量级。然而,在37℃水浴中通过对流加热可达到的升温速率只有10-100℃/min。通过微注射涂有炭黑的金纳米棒,用脉冲激光束刺激斑马鱼胚胎,在低浓度的CPA中实现了1.4×107℃/min的升温速率(图4e)。

图4. 玻璃化冷冻。a,玻璃化的步骤。b,自动装载CPA。c,水凝胶微囊化。d,液滴玻璃化。e,纳米级加热。
低温保存的进展
大多数大型或复杂的组织和器官不能忍受慢速冷冻引发的广泛的冰的形成和变形,也不能忍受玻璃化的高度集中的CPA和渗透压。因此,大型组织大多保存在液体状态,特别是低温状态(图5a)。然而,低温下的生物样本会迅速降解,并发生缺血性损伤(如缺血再灌注损伤)。
1. 温度控制的机器灌注
缺血性损伤可以通过机器灌注从被保存的组织中提供营养物质和清除废物来缓解,不同的组织和器官需要不同的灌注液和灌注温度(图5b)。常温机器灌注(37℃)可以恢复组织和器官的生理条件,规避冷损伤、缺血损伤和再灌注损伤,并且可以密切监测组织的活力和功能。
2. 过冷和深度过冷
由于自发的冰的形成,储存温度的降低将样品推向不稳定的过冷阶段,这将危及生物标本的生存能力。通过保持高的零下温度(高于-6℃),冻结的风险很低,过冷可以保存细胞和器官长达4天,过冷水和水溶液的主要冻结机制涉及水表面的异质冰核。因此,用不溶于水的油相封住水的表面可以“去除”这些主要的冰核点,并稳定过冷状态(图5c)。对于纯水来说,这种“深度过冷”状态可以在低至-20℃的温度下保持至少100天。
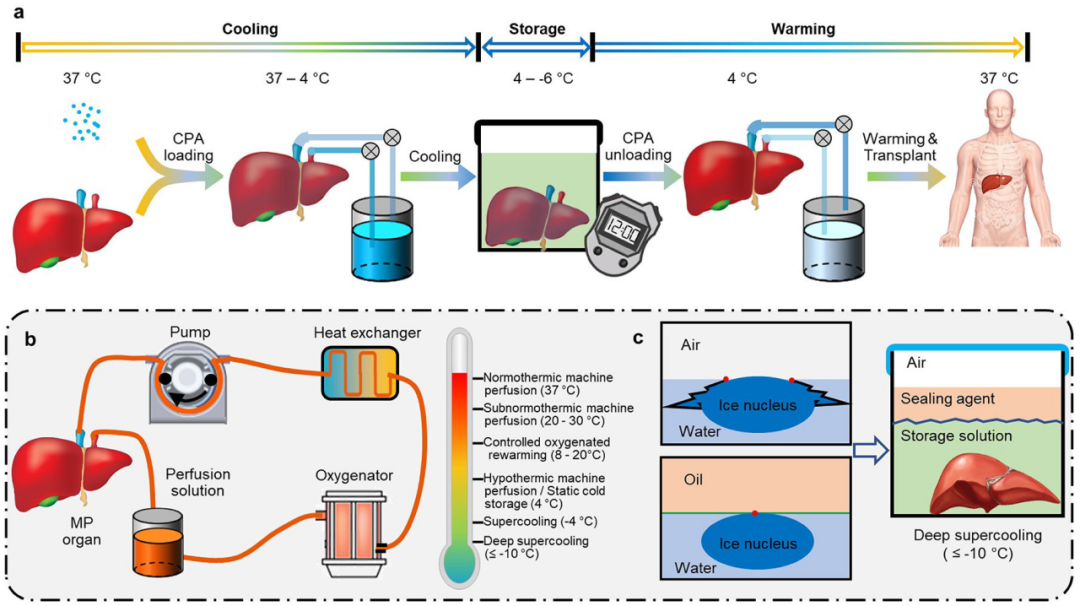
图5. 低温储存。a,组织和器官低温保存的步骤。b,温度控制的机器灌注。c,过冷和深度过冷。

图5. 低温储存。a,组织和器官低温保存的步骤。b,温度控制的机器灌注。c,过冷和深度过冷。
文章来源:
https://pubmed.ncbi.nlm.nih.gov/34426675/
细胞冻融研究的顶级帮手:艾尔温全自动可视化冻融仪
运用独家专利的接触式导冷技术,结合高清成像技术,在可视的条件下对样本进行冻融研究,最快降温速度超过1000℃/min,符合玻璃化冷冻所需的降温速度,复温时间在毫秒级别,避免重结晶对细胞的损伤。

更多产品详细信息可联系艾尔温

更多产品详细信息可联系艾尔温
400-150-9899

