卵母细胞冷冻保存是一种广泛用于人类辅助生殖技术和生育力保存的有效技术。玻璃化是最常用的人类卵细胞冷冻保存方法。临床实践中最常用的玻璃化方法是Cryotop方法(图1),由熟练的胚胎学家在15-20分钟内手工完成。由于细胞丢失、机械和渗透性损伤等原因,手工玻璃化的失败还是会发生。
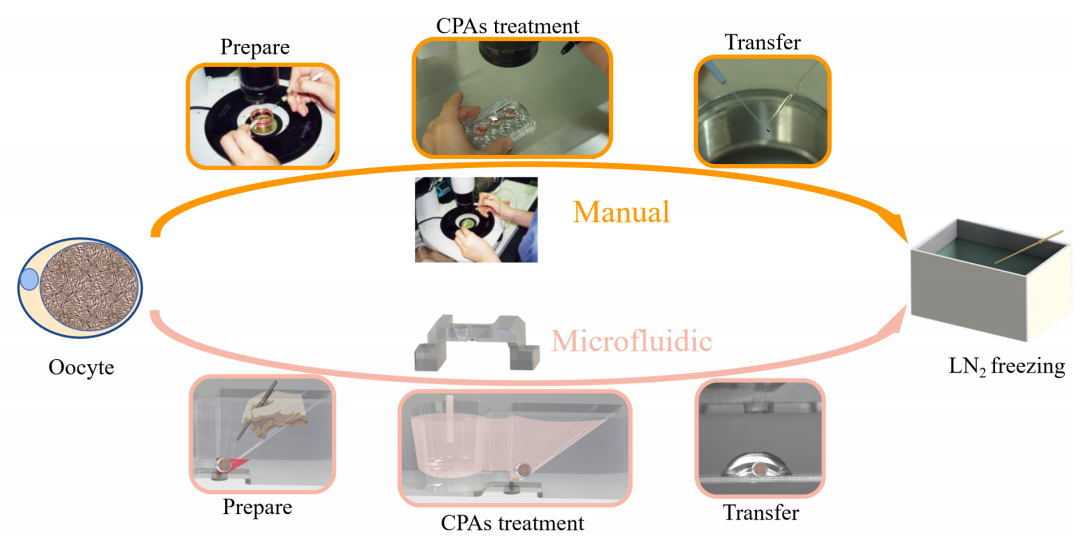 图1. 手动和微流控玻璃化方法示意图。
图1. 手动和微流控玻璃化方法示意图。
香港中文大学刘云辉教授团队、哈尔滨工业大学(深圳)的姜欣团队和香港大学深圳医院生殖医学中心的王天任团队报告了一种卵母细胞玻璃化微流控系统,它由一个开放式微流控芯片和一个配套装置组成。该系统提供了一个简单和标准化的玻璃化过程,操作者只需将卵母细胞装入芯片的指定区域,并操作配套设备,即可获得与Cryotop方法相同的玻璃化预处理效果。与手工操作相比,开放的微流控系统避免了频繁的卵母细胞移动造成的细胞丢失或损伤的风险,CPA(冷冻保护剂)以浓度梯度的形式引入,减少了渗透性损伤,标准化的流程消除了手工操作的不确定性。
 图1. 手动和微流控玻璃化方法示意图。
图1. 手动和微流控玻璃化方法示意图。香港中文大学刘云辉教授团队、哈尔滨工业大学(深圳)的姜欣团队和香港大学深圳医院生殖医学中心的王天任团队报告了一种卵母细胞玻璃化微流控系统,它由一个开放式微流控芯片和一个配套装置组成。该系统提供了一个简单和标准化的玻璃化过程,操作者只需将卵母细胞装入芯片的指定区域,并操作配套设备,即可获得与Cryotop方法相同的玻璃化预处理效果。与手工操作相比,开放的微流控系统避免了频繁的卵母细胞移动造成的细胞丢失或损伤的风险,CPA(冷冻保护剂)以浓度梯度的形式引入,减少了渗透性损伤,标准化的流程消除了手工操作的不确定性。
实验结果显示,用两种方法处理的解冻卵母细胞在存活率和质量(以MMP和ROS水平为特征)方面没有明显差异。相关论文以“Development of an Open Microfluidic Platform for Oocyte One-Stop Vitrification with Cryotop Method”为题发表在《Biosensors》上。
该系统的结构图及工作原理如图2所示。
 图2. 玻璃化系统的结构图和系统的工作原理。(a) 玻璃化系统由开放式微流控芯片和配套系统(注射泵、操作平台、转移系统和成像系统)组成。操作者手动将卵母细胞放入芯片,完成玻璃化预处理,在配套系统的协助下进行转移。整个操作过程中芯片的实时内部情况通过视觉反馈呈现给操作者。(b) 首先,Cryotop和含有卵细胞的开放式微流控芯片被固定在操作平台上,用于装载(ES、VS和空气)和卸载的注射器分别与芯片两侧的腔室和PDMS密封环用软硅胶管连接。(c) 转移过程的示意图。经过玻璃化预处理后,操作者按下转移手柄,PDMS密封环被压在开放的微流控芯片的上表面,形成一个密封的空间。通过外部压力将卵母细胞转移到Cryotop。
图2. 玻璃化系统的结构图和系统的工作原理。(a) 玻璃化系统由开放式微流控芯片和配套系统(注射泵、操作平台、转移系统和成像系统)组成。操作者手动将卵母细胞放入芯片,完成玻璃化预处理,在配套系统的协助下进行转移。整个操作过程中芯片的实时内部情况通过视觉反馈呈现给操作者。(b) 首先,Cryotop和含有卵细胞的开放式微流控芯片被固定在操作平台上,用于装载(ES、VS和空气)和卸载的注射器分别与芯片两侧的腔室和PDMS密封环用软硅胶管连接。(c) 转移过程的示意图。经过玻璃化预处理后,操作者按下转移手柄,PDMS密封环被压在开放的微流控芯片的上表面,形成一个密封的空间。通过外部压力将卵母细胞转移到Cryotop。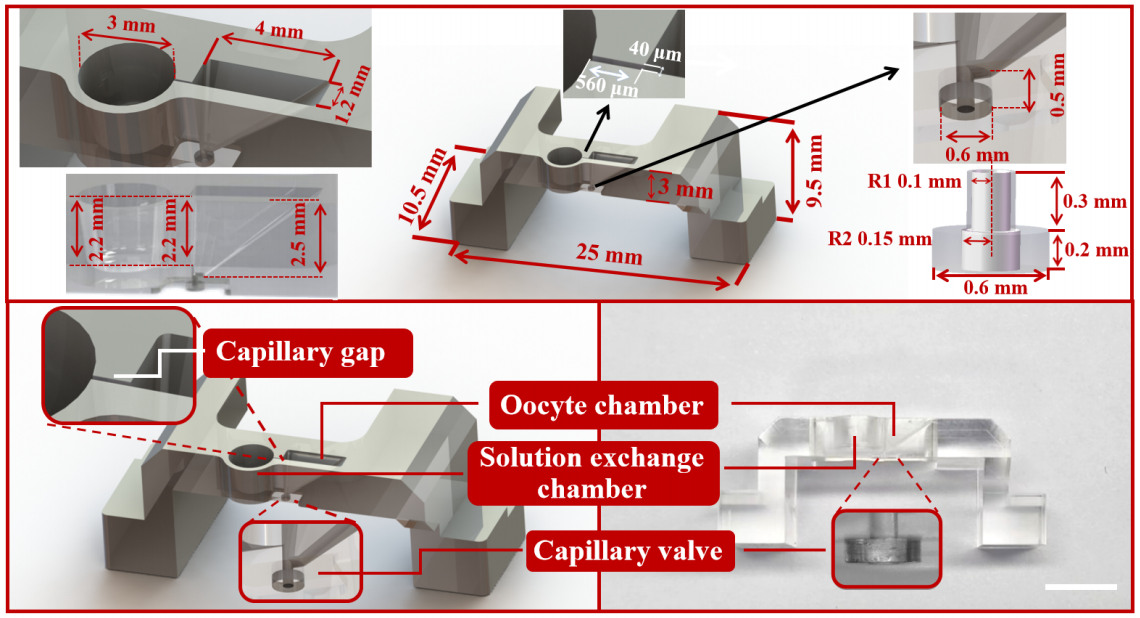
图3. 开放式微流控芯片的尺寸细节、结构图和物理图。
准备工作完成后,整个玻璃化操作被分为5个步骤(图4)。
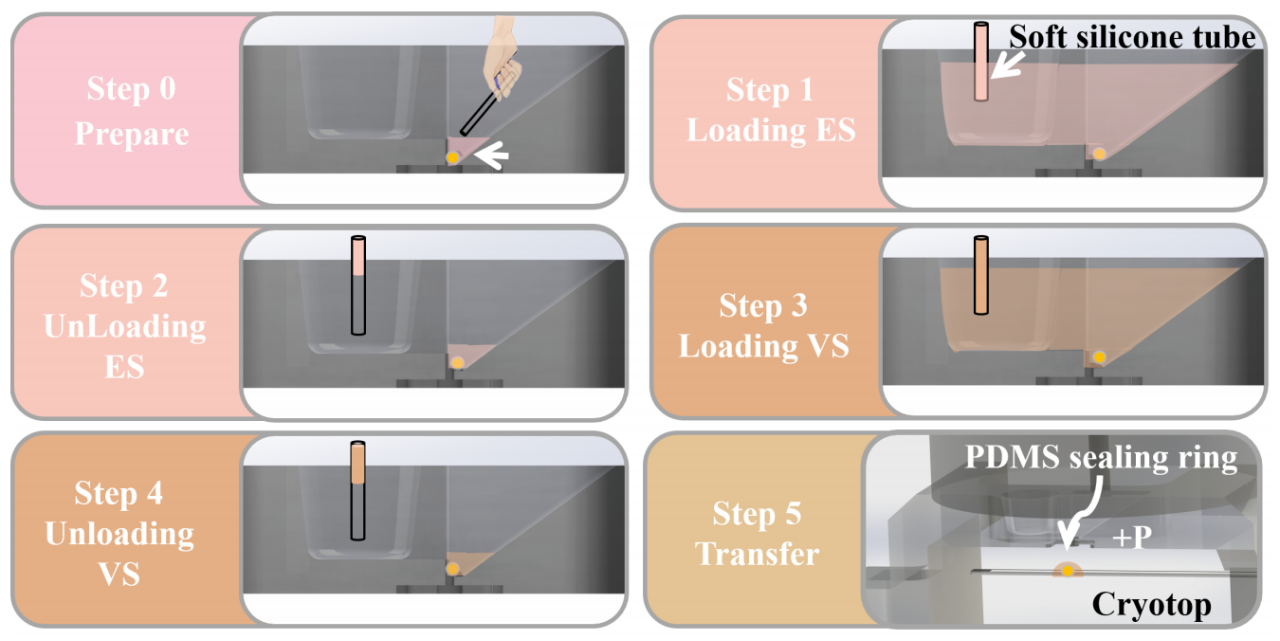 图4. 开放式微流控芯片上玻璃化的操作步骤:准备、装载和卸载ES/VS以及转移。
图4. 开放式微流控芯片上玻璃化的操作步骤:准备、装载和卸载ES/VS以及转移。
为了确保所设计的芯片能够满足要求,对关键结构毛细管阀门中的流体行为进行了数值模拟(图5)。
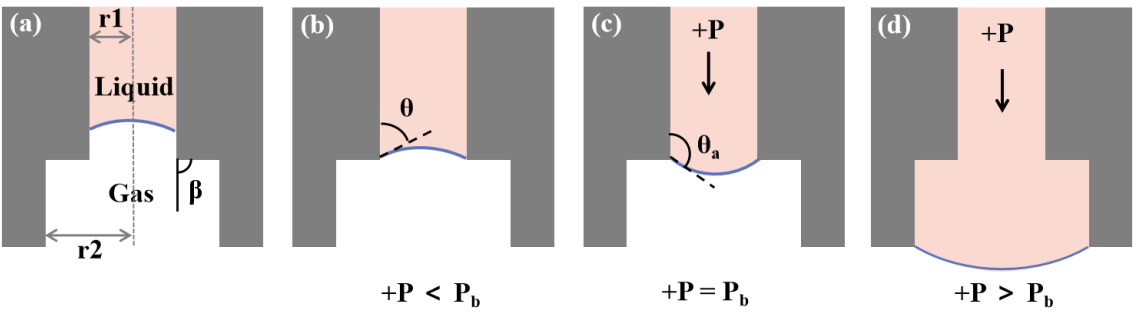
图5. 毛细管阀中液体流动的不同情况。(a) 毛细管阀的内部结构图;内半径(r1: 100 µm, r2: 150 µm)有两次突然膨胀,通道膨胀角β为90◦。(b) 液体到达毛细管阀,没有外部压力,半月面停在微通道出口边缘。(c) 外部压力逐渐增加,半月板的凸度和接触角变大。(d) 当外部压力超过临界爆破压力时,毛细管阀被打开,液滴被转移到Cryotop。

图5. 毛细管阀中液体流动的不同情况。(a) 毛细管阀的内部结构图;内半径(r1: 100 µm, r2: 150 µm)有两次突然膨胀,通道膨胀角β为90◦。(b) 液体到达毛细管阀,没有外部压力,半月面停在微通道出口边缘。(c) 外部压力逐渐增加,半月板的凸度和接触角变大。(d) 当外部压力超过临界爆破压力时,毛细管阀被打开,液滴被转移到Cryotop。
开放式微流控芯片的流体模拟和性能表征
实验发现,卵母细胞室中CPA浓度的变化率对玻璃化有很大影响(图6)。示踪实验和数值模拟表明,在开放式微流控芯片上,CPA可以以浓度梯度的形式引入,与人工Cryotop方法相比,这将减少CPA突变引起的渗透性休克的风险。
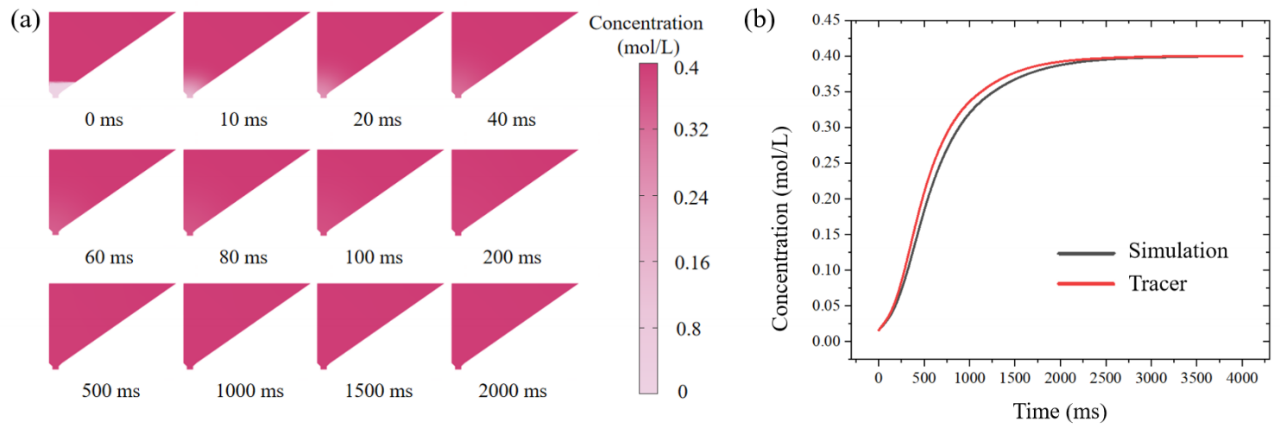 图6. 卵母细胞周围的理论和实验VS浓度与时间的关系。(a) 扩散条件下卵母细胞室中模拟的随时间变化的蔗糖浓度(初始浓度上部:0.4 mol/L;下部:0 mol/L)。(b) 灰色:随时间变化的卵细胞室中的蔗糖浓度预测;红色:实验测量的卵细胞室中荧光示踪剂的强度。
图6. 卵母细胞周围的理论和实验VS浓度与时间的关系。(a) 扩散条件下卵母细胞室中模拟的随时间变化的蔗糖浓度(初始浓度上部:0.4 mol/L;下部:0 mol/L)。(b) 灰色:随时间变化的卵细胞室中的蔗糖浓度预测;红色:实验测量的卵细胞室中荧光示踪剂的强度。研究者模拟毛细管阀的临界爆破压力,975 Pa被认为是毛细管阀的临界爆破压力(图7)。
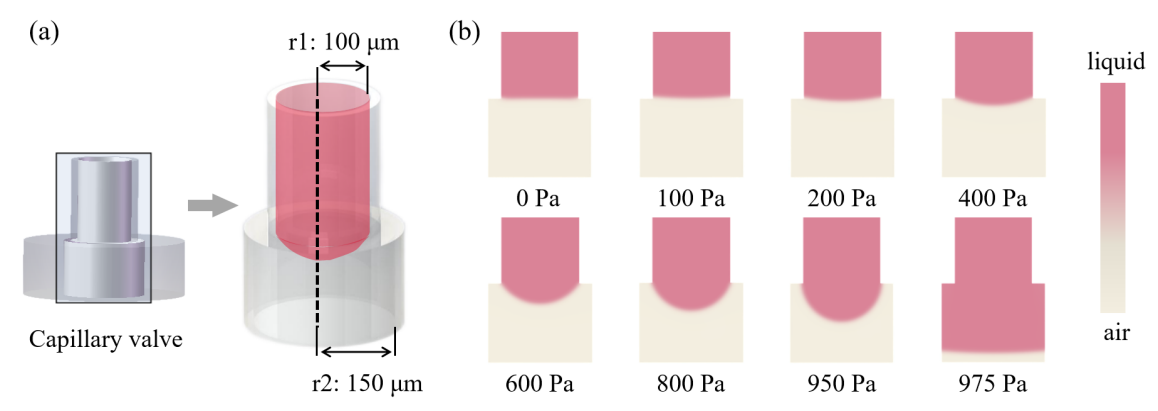 图7. 毛细管阀的临界爆破压力的数值模拟。(a) 毛细管阀的建模。(b) 在不同的外部压力下下半月板的变形(液体:粉红色;空气:灰色)。
图7. 毛细管阀的临界爆破压力的数值模拟。(a) 毛细管阀的建模。(b) 在不同的外部压力下下半月板的变形(液体:粉红色;空气:灰色)。
在验证了芯片的两个关键部分的可靠性之后,芯片的整体工作流程被描述出来(图8)。
 图8. 在系统玻璃化的整个过程中,成像系统对微粒子进行了跟踪。(a) 操作者将微粒子放入芯片中。(b-g) 微粒子完成了玻璃化预处理并被转移到Cryotop。(h) Cryotop上的液滴含有微粒子。
图8. 在系统玻璃化的整个过程中,成像系统对微粒子进行了跟踪。(a) 操作者将微粒子放入芯片中。(b-g) 微粒子完成了玻璃化预处理并被转移到Cryotop。(h) Cryotop上的液滴含有微粒子。成功率和卵细胞存活率
与人工Cryotop操作相比,该系统的存活率略高(GV期:97.4% VS 94.4%,MII期:97.8% VS 97.8%),这是由于CPA的不同装载方法和操作的可重复性。一方面,在手工操作下,CPAs的浓度变化突然,而微流控芯片中的CPAs浓度变化比较平缓。另一方面,在涉及复杂手工操作的实验中,操作者很难保证实验的一致性。
对卵母细胞的冷冻没有差异
两组GV或MII卵母细胞在形态学上的变化没有很大差异(图9),这表明无论是通过传统的手工操作还是微流控系统进行的玻璃化和解冻程序,卵母细胞都能存活。
 图9. 通过与传统的人工玻璃化方法比较,评估从微流控玻璃化解冻的卵母细胞。(a,c)GV卵母细胞和(b,d)MII卵母细胞(极体被挤出)从手动玻璃化和微流控玻璃化解冻。
图9. 通过与传统的人工玻璃化方法比较,评估从微流控玻璃化解冻的卵母细胞。(a,c)GV卵母细胞和(b,d)MII卵母细胞(极体被挤出)从手动玻璃化和微流控玻璃化解冻。研究者接下来进行了一些生物分子实验,以测试这些卵母细胞是否发生了功能上的变化,经过统计分析,两组之间没有明显差异(图10a,b)。此外,玻璃化解冻的MII卵母细胞的细胞质的ROS水平被测量,绿色荧光强度的量化显示两组之间没有明显差异(图10c,d)。
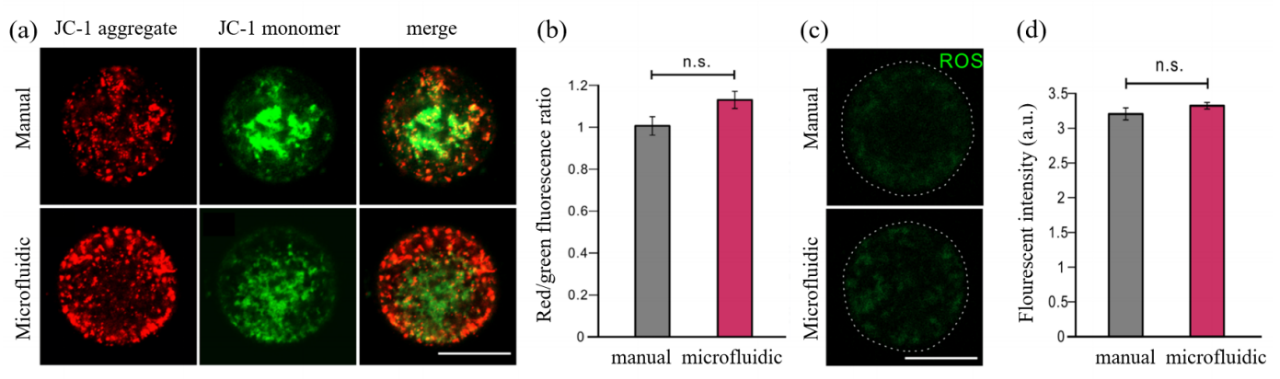
图10. 卵母细胞的JC-1染色和ROS水平测量。(a) 通过JC-1染色测量解冻的MII卵母细胞的MMP水平。(b) 卵母细胞的红/绿荧光比例在手工组和微流控组之间进行量化。(c) 手工组和微流控组之间解冻的GV卵母细胞的ROS水平。(d) 对两组的ROS水平进行了测量和量化。

图10. 卵母细胞的JC-1染色和ROS水平测量。(a) 通过JC-1染色测量解冻的MII卵母细胞的MMP水平。(b) 卵母细胞的红/绿荧光比例在手工组和微流控组之间进行量化。(c) 手工组和微流控组之间解冻的GV卵母细胞的ROS水平。(d) 对两组的ROS水平进行了测量和量化。
总的来说,基于上述生物分子实验的结果,研究者得出结论,通过这两个系统进行低温保存的卵母细胞,没有检测到形态学或功能的变化。
讨论
研究者声称这是第一份基于Cryotop方法的微流控系统完成玻璃化程序的报告。通过该平台,玻璃化过程被有效地简化和标准化,从而降低了对操作员的要求,有效地避免人工操作过程中的误操作,并消除操作者的个体差异,而且成本也比商业自动玻璃化平台低很多。研究者相信该系统将极大地促进辅助生殖,并为生殖细胞玻璃化提供一个标准的解决方案。
文章来源:
https://pubmed.ncbi.nlm.nih.gov/36140151/
安全、标准、自动:iKV-Rewake细胞自动复苏仪
安全、标准、自动:iKV-Rewake细胞自动复苏仪
iKV-Rewake替代传统水浴锅,完美解决水源污染风险、操作过程差异化、流程繁琐、预热时间长等痛点。开机3分钟以内预热完成,只需将冻存管插入加热孔,无需任何其他操作,3分钟以内复苏完成并自行弹出。

更多产品详细信息可联系艾尔温
400-150-9899

